近日,我所生物技术部生物质高效转化研究组(1816组)赵宗保研究员团队与瑞典查尔姆斯理工大学(Chalmers University of Technology)Jens Nielsen教授、德国法兰克福大学(Goethe University Frankfurt)Martin Grininger教授合作在真菌脂肪酸合酶改造研究中取得新进展:设计改造了脂肪酸合酶,并扩展了脂肪酸合成机器的产物谱,相关研究成果发表在Nature Chemical Biology(DOI:10.1038/nchembio.2301)上,并将以封面故事形式在该刊四月期正式发表。
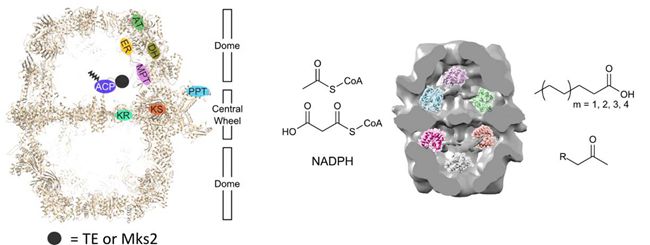
脂肪酸是组成细胞的重要分子,也是生物燃料和油脂化工的基础原料。脂肪酸合酶(FAS)是细胞合成脂肪酸的关键酶,而真菌来源的FAS催化活性相对较高。真菌FAS是多功能酶,含7个不同催化结构域(AT、ER、DH、MPT、KR、KS和PPT)和1个酰基载体蛋白(ACP)结构域,分子量约270万道尔顿,可组装成笼状超分子结构。尽管真菌FAS的催化机制和晶体结构已被阐释,但因其过于复杂,通常被认为很难进行操纵和改造。
该研究团队前期通过对产油酵母多组学研究发现,圆红冬孢酵母携带一种含两个酰基载体蛋白(ACP)结构域的FAS(Nat. Commun.2012,3,1112);通过冷冻电镜分析表明,该FAS也组装成典型笼状结构(Protein Sci.2015,24,987)。近期研究发现,只需一个ACP即可行使脂肪酸合成功能。因此,研究人员用细菌来源的硫酯酶(TE)替换其中一个ACP,所得杂合FAS主要产生中/短链长的脂肪酸;类似地,改造另外两种真菌FAS,也得到了预期结果;更重要的是,利用该策略引入甲基酮合酶(Mks2),所得杂合FAS能合成长链甲基酮。该研究结果表明,将异源蛋白嵌入真菌FAS笼型超分子结构,可得到具有新功能的脂肪酸合成机器,这可为借用脂肪酸合成途径进行生物制造提供新路线。
上述研究得到国家自然科学基金委的资助,并得到我所生物分离分析新材料与新技术研究组(1809组)和公共分析测试组(DNL2001)的协助。(文/图 朱志伟)






