近日,我所生物技术研究部生物分离与界面分子机制研究组(1824组)卿光焱研究员团队与大连理工大学刘波教授合作,发现了细胞外微囊泡可用于治疗神经退行性疾病,例如阿兹海默疾病(AD)等。
AD是最常见的神经退行性疾病,是全球最大的公共卫生挑战之一。目前,由于治疗AD的药物存在对靶点的抑制效果差,无法跨越血脑屏障、容易引起机体免疫反应等特点,使得此疾病的治疗一直陷入僵局,迫切需要开发新的疗法来延缓阿兹海默疾病发作或改变阿兹海默疾病的进程。AD的主要病理标志是细胞外β-淀粉样蛋白(Aβ)沉积形成的老年斑和细胞内Tau蛋白过度磷酸化导致的神经原纤维缠结,其中Aβ肽聚集被认为是引起AD最主要的原因之一。
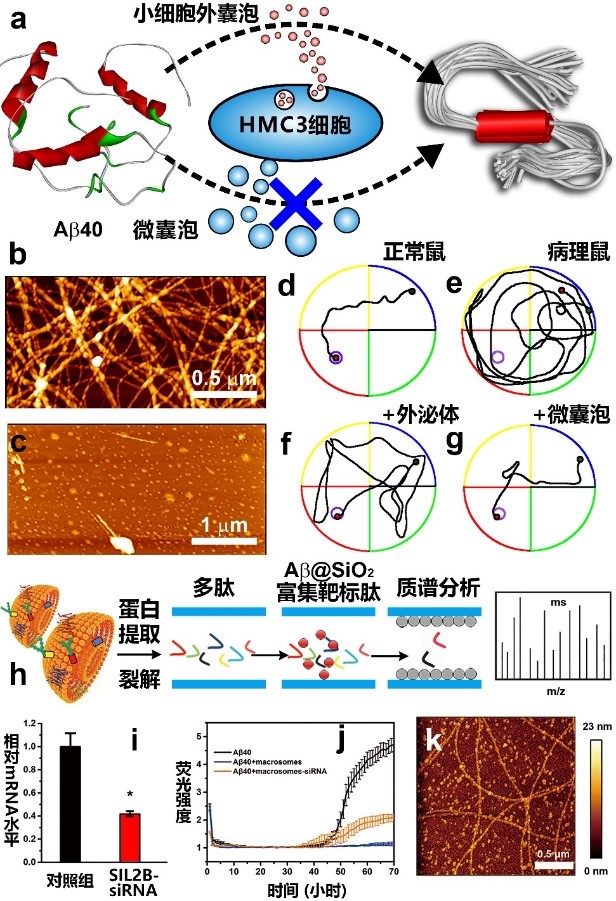
细胞外囊泡具有穿越血脑屏障的能力,以及不引起机体炎症反应等特点备受关注,基于细胞外囊泡的疾病治疗方法也在不断涌现。本工作通过人源小胶质细胞释放的细胞外囊泡抑制Aβ肽聚集,从而实现对AD的治疗。团队通过超速离心分离,得到人源小胶质细胞释放的大小不同、具有异质性的细胞外囊泡,包括小的细胞外囊泡(约126nm)和微囊泡(200至600nm)。研究发现,小的细胞外囊泡无法抑制Aβ肽聚集,而微囊泡可以强烈地抑制Aβ肽聚集。动物实验表明,微囊泡显著地减少AD小鼠脑内的Aβ斑块,进而改善AD小鼠的认知能力,减轻神经炎症,这表明微囊泡有可能是一种潜在的治疗AD的药物。蛋白质组学分析揭示,人源小胶质细胞释放的微囊泡表面汇聚了多种抑制Aβ聚集的蛋白,减少这些蛋白的表达后,微囊泡抑制Aβ肽聚集的效果明显减弱,这说明微囊泡上的这些蛋白通过协同作用的方式治疗AD。此种内源性的基于细胞外囊泡的疗法为神经退行性疾病的治疗提供了新方向。
卿光焱团队持续开展生物界面与Aβ肽相互作用研究,将手性半胱氨酸修饰到氧化石墨烯的表面,研究分子手性对Aβ肽纤维化的影响(J. Am. Chem. Soc.,2014);进一步将人工手性表面的研究,扩展到真实的手性磷脂表面,合成手性氨基酸修饰的磷脂囊泡,在AD早期预防和治疗中具有很好的应用前景,为脂质体类抑制剂的发展提供了一个方向(Chem. Sci.,2020;ACS Chem. Neuro. Sci.,2022)。此外,团队利用手性磷脂囊泡,实现了对朊蛋白片段纤维化过程的精确调控(Chin. Chem. Lett.,2023)。
相关研究以“Secreted endogenous macrosomes reduce Aβ burden and ameliorate Alzheimer’s disease”为题,于近日发表在《科学—进展》(Science Advances),该工作的第一作者是我所1824组和大连理工大学联合培养博士生王存利。上述工作得到国家自然科学基金、我所创新基金等项目的资助。(文/图 王存利)






