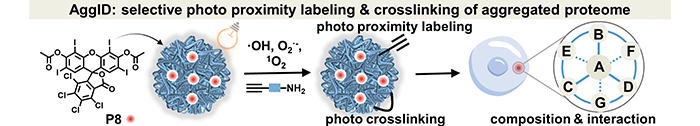
近日,我所精细化工研究室蛋白质折叠与聚集研究组(212组)刘宇研究员和生物技术研究部生物分子高效分离与表征研究组(1810组)张丽华研究员团队合作,通过对有机小分子光敏催化剂进行筛选和结构优化,实现了活细胞内聚集态蛋白质组的靶向光敏邻近标记和交联,原位解析了其组成成份和相互作用信息。
蛋白质分子需要折叠成特定的三维结构才能行使其正确的生理功能。然而,在发生基因突变或应激条件下,蛋白质容易发生错误折叠、聚集并最终形成难以降解的聚集态蛋白质。这一生理现象会导致诸如神经退行性疾病、代谢紊乱以及癌症等蛋白质构象疾病。揭示聚集态蛋白质的位置、形貌、组分和互作信息对于揭示上述疾病的发病机制,寻找新的诊疗靶点具有积极的科学和临床意义。
本工作中,刘宇与张丽华团队合作,通过筛选有机小分子光敏催化剂,发现了对聚集态蛋白质具有强结合力的有机小分子骨架,最终实现了胞内聚集态蛋白质组的组分鉴定和互作网络分析。刘宇团队从传统有机光敏剂骨架结构出发,发现具有高疏水常数(cLogP)的分子对聚集态蛋白质有更高的结合能力;基于此性质和光敏剂自身的光催化性能,团队将其应用于细胞内的聚集态蛋白质邻近标记和靶向原位交联中。张丽华团队建立了聚集态蛋白质分离富集、蛋白质组学和交联质谱解析新方法,鉴定了药物应激时聚集态蛋白质组的组分及互作网络信息,揭示了在化疗药硼替佐米(Bortezomib)作用下癌细胞通过分子伴侣介导的自噬途径实现聚集态蛋白质的降解,而非蛋白酶体-泛素化通路。该工作为研究神经退行性疾病中致病聚集态蛋白质提供了新的分析方法。
近年来,刘宇团队基于靶向聚集态蛋白质内部孔道特征微环境的探针设计思路(Angew. Chem. Int. Ed.,2021;Angew. Chem. Int. Ed.,2021),实现了胞内致病聚集态蛋白质的位置形貌分析(Anal. Chem.,2021)、共聚集过程的机制解析(Chem. Sci.,2021)和内部微环境异质性的定量分析(Angew. Chem. Int. Ed.,2021;ACS Sens.,2022)。此外,基于上述靶向聚集态蛋白质的分子结构,刘宇团队通过衍生天然荧光蛋白质的发色基团,实现其三重态光交联性质的理性调控,初步揭示了细胞内聚集态蛋白质之间的相互作用信息(Angew. Chem. Int. Ed.,2023)。
上述研究以“A Cell-Permeable Photosensitizer for Selective Proximity Labeling and Crosslinking of Aggregated Proteome”为题,于近日发表在《先进科学》(Advanced Science)上。该工作的共同第一作者是我所212组博士研究生冯焕与1810组赵群研究员。该工作得到了国家自然科学基金、大连市杰出青年科学基金、中国科学院青促会、我所创新基金等项目的资助。(文/图 冯焕、赵群)






