近日,我所生物技术研究部分子探针与荧光成像研究组(1818组)乔庆龙副研究员和徐兆超研究员团队发展了能够与RNA特异性可逆结合,在活细胞内对细胞核核仁稳定成像的“缓冲荧光探针”Nu-AN,实现了对核仁动态轮廓的成像,并通过活细胞内药物诱导下核仁特定形态的可视化,为核仁应激试剂的筛选提供可视化的工具。
核仁是细胞核内最大的无膜细胞器,因其具有多样的生理和病理功能而受到广泛关注,这些功能与其形态密切相关。核仁主要作为核糖体生物合成的中心,同时也具有非核糖体功能,包括调控有丝分裂、控制细胞周期和参与细胞应激。核仁在形态方面,包括形状、大小以及细胞核内核仁数量,反映其生理活性,并与各种人类疾病(如癌症、神经退行性疾病和衰老)相关。例如,在癌细胞中,由于细胞快速生长和增殖导致对核糖体生物合成和蛋白质合成的迫切需求,使得癌细胞中的核仁比正常细胞中的核仁尺寸更大、数目更多,形状不规则等。核仁大小也与细胞寿命具有很强的相关性,较小的核仁是细胞长寿的标志。此外,在核仁应激条件下,核仁形态的变化尤为明显,为疾病诊断和药物筛选提供了潜在方法。
然而,核仁形态的荧光成像面临挑战。由于这种无膜细胞器的动态性和无定形性,要求核仁探针能够选择性地识别整个核仁结构而不干扰核仁功能,并具有高光稳定性,确保进行动态核仁成像。而基因编码的荧光蛋白标记核仁蛋白的方法会破坏核仁的源生性;现有的小分子染料依赖与RNA的强烈静电作用标记核仁,不仅在细胞中容易造成荧光背景,还有可能干扰核仁的功能。
1818组前期开发了细胞内脂滴动态识别“缓冲荧光探针”LD-FG(Angew. Chem. Int. Ed.,2021),有效解决了在长时间动态超分辨成像过程中染料光不稳定的问题。受“缓冲荧光探针”策略的启发,在本工作中,团队将3-吡咯啉环引入到萘酰亚胺中,开发了可逆结合并识别RNA的核仁“缓冲荧光探针”Nu-AN。研究发现,3-吡咯啉环并入萘酰亚胺荧光团既保持了平面性又保留扭曲分子内电荷转移(TICT)的特性,同时Nu-AN还表现传统萘酰亚胺染料氢键淬灭荧光的特征。与RNA结合后,Nu-AN驻留在RNA的疏水腔内,抑制TICT并减少氢键效应,从而产生荧光增强的效果。Nu-AN是电中性的,并且不含有可质子化的碱性基团,所以与RNA的相互作用较弱,能可逆的与RNA结合并伴随荧光增强的响应。在活细胞中,Nu-AN可以有效地、可逆地染色核仁,同时避免商品化RNA探针在线粒体或溶酶体中错误定位的问题。这种可逆性结合不仅最大限度地减少了对核仁的结构干扰,保留了核仁的活性,而且还在核仁外形成了“染料池”。当核仁内的探针发生光漂白,则可以快速招募来自“染料池”的新探针,确保核仁成像的光稳定性。
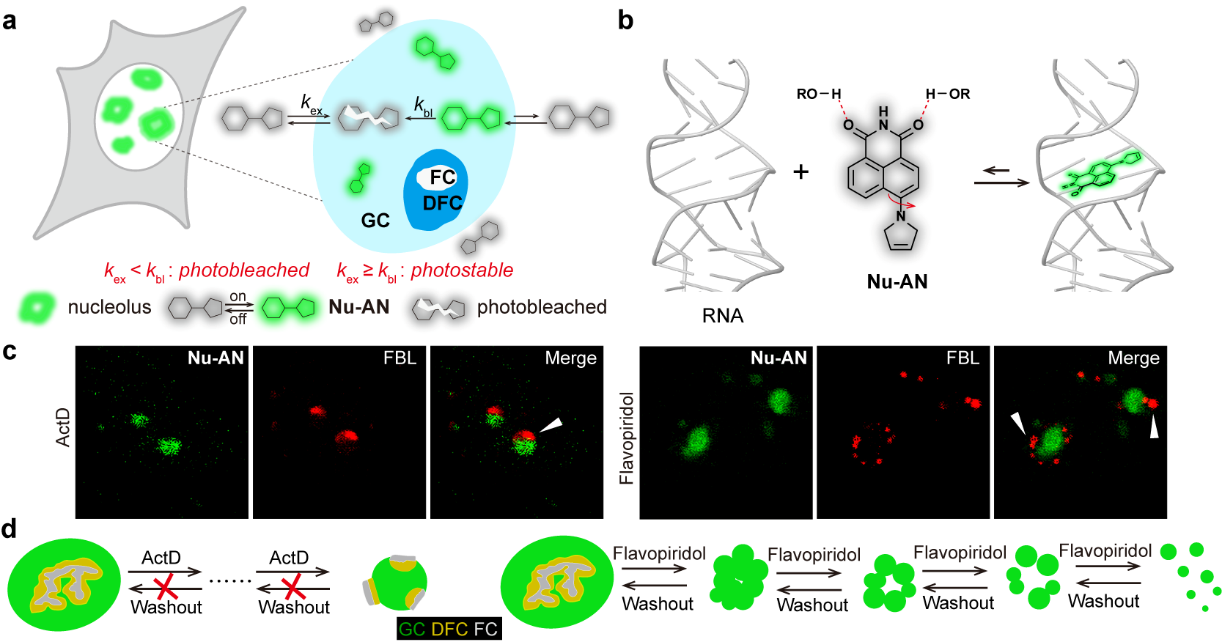
Nu-AN与RNA的可逆结合和选择性荧光点亮特性确保了对活细胞内核仁的特异和稳定的荧光成像,使其特别适用于在不破坏核仁功能的情况下可视化RNA富集的核仁亚结构:颗粒成分(GC)。通过Nu-AN对核仁GC亚结构的标记与基因编码的荧光蛋白联合使用,实现核仁整体形态的成像。
核仁药物往往会引起核仁形态的变化。借助于Nu-AN对核仁形态的可视化,团队观察到两种药物诱导核仁形态的特异性变化:ActD处理导致了压力“帽”的形成和核仁尺寸的减小;在Flavopiridol的影响下,核仁呈现出从紧凑完整状态到严重分散状态的逐渐过渡。此外,研究还发现前者对核仁的形态影响是不可逆的,而后者形态变化看似剧烈却是可逆的。这些成像结果也充分说明了核仁作为无膜细胞器的高度流动性和有组织性。
无膜细胞器逐渐被发现并被作为细胞内一类特殊结构功能单元,但它们不断变化和无定形的形态特征,使得对其结构和功能的研究一直存在挑战。核仁作为细胞内众多的无膜细胞器之一,也是目前已知的最大的无膜细胞器,它的高度动态和精巧的结构赋予了它多功能的特性,使其与细胞内其他功能单元协调统一地维持细胞的生命活动。Nu-AN有望为核仁生物学领域提供活细胞核仁形态学研究的工具,同时,这一探针的设计为细胞内其他无膜细胞器的探针的开发开辟了新的途径。未来,其他多种无膜细胞器探针的开发将填补无膜细胞器可视化空白,帮助提升对细胞生物学的认知。
相关研究成果以“RNA Buffering Fluorogenic Probe for Nucleolar Morphology Stable Imaging And Nucleolar Stress-Generating Agents Screening”为题,发表在《先进科学》(Advanced Science)上。该工作的第一作者是我所1818组博士研究生江文钞。研究工作得到国家自然科学基金、我所创新基金等资助。(文/图 江文钞)
文章链接:https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202309743






