近日,我所本草物质科学研究室(2800组群)梁鑫淼研究员和朴海龙研究员团队运用前沿空间代谢组学和空间转录组学技术,深入剖析了肝脏的区带化特性(Liver Zonation)。该团队结合肝脏区带化特性,揭示了G蛋白偶联受体——GPR35在调节代谢功能障碍相关脂肪肝病(MASLD)中的关键机制,有望为脂肪肝病的预防、治疗和管理,以及药物靶点和相关药物开发等提供新的策略和路径。
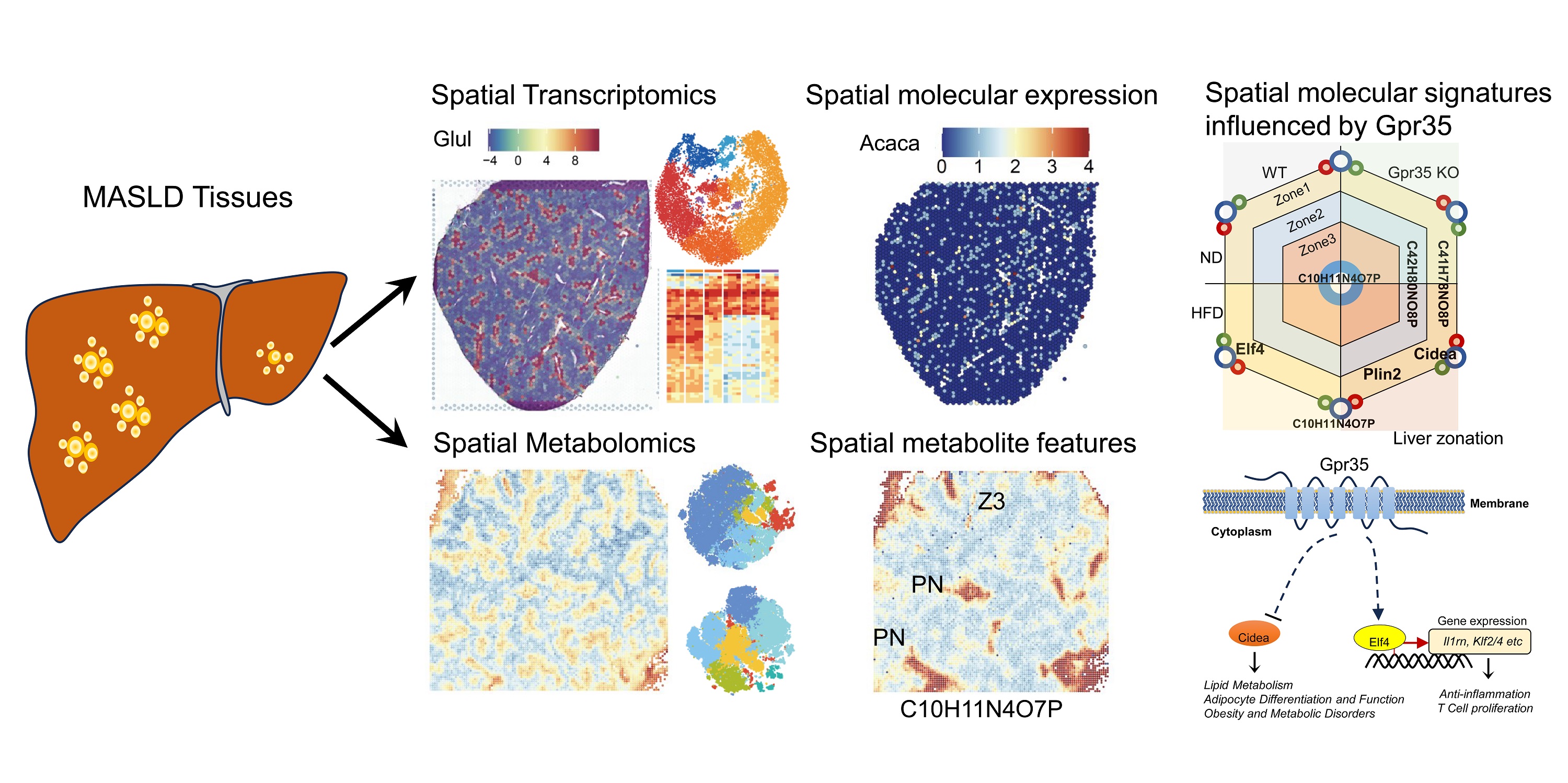
在全球范围内,代谢功能障碍相关脂肪肝病(MASLD)作为一种日益增长的代谢性疾病,对人类健康构成了严峻挑战。然而,对于其深层分子机制的理解仍然有限。
研究发现,在高脂饮食条件下,GPR35基因敲除(KO)小鼠体重显著增加,脂肪肝症状加剧,肝脏中甘油三酯(TG)积累增多,并伴随着鞘脂代谢的活跃,表明GPR35与肝脏脂代谢的调控关系密切。本研究进一步采用了空间转录组学和空间代谢组学技术进行解析,对多种组学进行整合,揭示了在肝脏不同区带内GPR35对代谢物和基因的调控特征。这些区带化特征揭示了GPR35调节肝脏脂代谢的潜在机制。其中,值得注意的是,抗炎因子ELF4在肝脏Zone 2区域受到调控,而脂质稳态关键因子CIDEA在Zone 1区域受到调控。此外,肌苷-3',5'-环磷酸(3',5'-cyclic IMP)在中心静脉区域的分布,在GPR35 KO小鼠肝脏区域中减少。研究不仅阐明了GPR35在肝脏区带化及MASLD中的作用,还发现了新的可能与GPR35功能相关的基因及代谢物,为深入研究GPR35调节脂质代谢的机制提供了新的视角。这些发现对于开发MASLD的新疗法具有一定的指导意义,有望为脂肪肝病的治疗和管理提供新的策略。
朴海龙等长期开展代谢稳态、癌症代谢的功能分子机制,及基于多组学整合的疾病生物分子网络研究,在前期工作中发现了肝癌脂代谢异常的关键分子机制(Nature Communications,2022),肝癌代谢异质性相关分子分型及潜在生物学机制(Advanced Science,2021;Nature Communications,2024)和代谢分子促进癌症发生和转移的功能与机制(Cell Metabolism,2021;Gut,2023;Life Metabolism,2023)。
相关成果以“Spatial multi-omics characterizes GPR35-relevant lipid metabolism signatures across liver zonation in MASLD”为题,发表在Life Metabolism上。该工作的共同第一作者为我所出站博士后吾夏尔·吾提克尔博士、博士研究生张怡然。该工作得到了国家重点研发计划、国家自然科学基金、辽宁省兴辽英才计划、大连市科技之星、我所创新基金等项目的资助。(文/图 张怡然、吾夏尔·吾提克尔)






