近日,我所生物技术研究部生物分子高分辨分离分析及代谢组学研究组(1808组)刘心昱研究员、许国旺研究员团队与郑州大学第一附属医院李向楠教授合作,基于功能代谢组学策略,整合毛细管电泳-飞行时间质谱的代谢组学分析和分子生物学手段,揭示了表皮生长因子受体(EGFR)突变型肺腺癌的嘌呤代谢重塑及其作用机制,有望为EGFR突变型肺腺癌提供新的治疗策略。
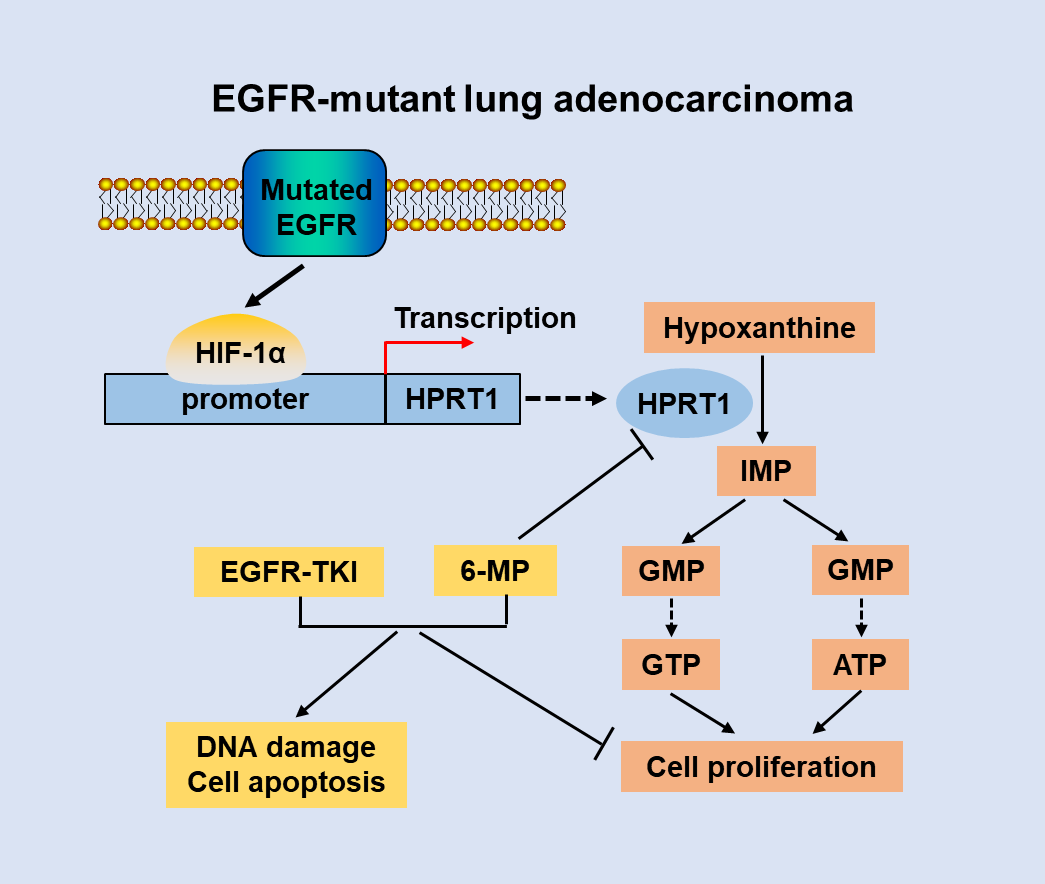
EGFR突变是导致肺腺癌恶性肿瘤的重要原因。代谢重编程是癌的重要标志,嘌呤代谢是肿瘤进展和耐药的关键代谢途径。然而,嘌呤代谢在EGFR突变型肺腺癌中的作用尚不清楚。
本工作中,团队通过代谢组学研究发现,EGFR突变型的肺腺癌具有异常活跃的嘌呤代谢,进一步功能研究揭示,突变的EGFR上调了嘌呤补救合成通路中的次黄嘌呤磷酸核糖基转移酶(HPRT1)的表达,从而促进EGFR突变型肺腺癌的嘌呤代谢和肿瘤发生。团队通过深入的机制研究,阐明了突变的EGFR通过蛋白稳定性增加转录因子HIF-1α的表达,HIF-1α与HPRT1的启动子结合并转录激活HPRT1的表达,增强嘌呤代谢,维持EGFR突变型肺腺癌肿瘤细胞的快速增殖。此外,团队还发现,HPRT1抑制剂(6-MP)联合EGFR受体酪氨酸激酶抑制剂(gefitinib),通过抑制细胞增殖诱导DNA损伤和细胞凋亡,抑制肿瘤的生长。该研究表明干预肿瘤的嘌呤代谢可能成为临床治疗EGFR突变型肺腺癌的新靶点。
相关成果以“HIF-1α-HPRT1 axis promotes tumorigenesis and gefitinib resistance by enhancing purine metabolism in EGFR-mutant lung adenocarcinoma”为题,发表在Journal of Experimental & Clinical Cancer Research上。该工作的第一作者为我所1808组博士后耿鹏宇。该工作得到了国家自然科学基金、中国科学院B类先导专项“多维大数据驱动的中国人群精准健康研究”、中国科学院青促会、我所创新基金等项目的资助。(文/图 耿鹏宇)






