近日,我所生物技术研究部分子探针与荧光成像研究组(1818组)徐兆超研究员、乔庆龙副研究员团队发展了一种“靶控自闪烁”荧光探针,并将其命名为“Blinkogenic Probe”,这类探针只有在识别靶标后才会激活自闪烁荧光开关性能,排除了非靶向单分子定位的干扰,提升了单分子超分辨成像的定位准确性,实现了活细胞内免洗动态单分子超分辨成像。
单分子定位显微镜(SMLM)作为重要超分辨成像技术之一,能够在单分子分辨率下,可视化生物分子的分布、分子间的相互作用、纳米尺度的细胞器结构、单个分子的催化反应等。其突破纳米成像极限的核心在于荧光开关分子在荧光“亮”态(ON)和“暗”态(OFF)之间转换的能力,以保证单个分子的荧光信号在不同时间点被区分,并进行精确定位。传统的发光调控策略,例如紫外光激活、高浓度外源性亲核试剂或氧化还原调节剂、探针与靶点结合解离等,虽能获取稀疏的荧光闪烁信号,却因生物兼容性问题难以在活细胞内实现原位、动态的超分辨成像,同时,由于缺乏准确的靶点识别能力,SMLM成像技术受到单分子定位时的错误信号干扰。
1818组在前期工作中基于自闪烁荧光探针建立了罗丹明开关分子吉布斯自由能的差值(ΔGC-O)与开环比例的线性关系(R2=0.965),设计了特定开环比例的罗丹明开关分子,以此高效地开发出了多颜色自闪烁荧光探针,并将其用于活细胞内的动态单分子定位超分辨成像(Angew. Chem. Int. Ed,2020)。尽管自闪烁荧光探针在超分辨成像中展现出重要应用潜力,其仍面临着成像背景高等挑战。例如,由于细胞内存在未反应或非特异性结合的自闪烁探针,这些探针同样会表现出自发闪烁特性,会产生强烈的背景信号并严重干扰目标分子的定位,降低了成像的定位准确度。而随着分辨率的不断提高,尤其是当接近1nm时,背景信号的问题将变得更加突出,成为制约超分辨成像技术进一步发展的关键因素。
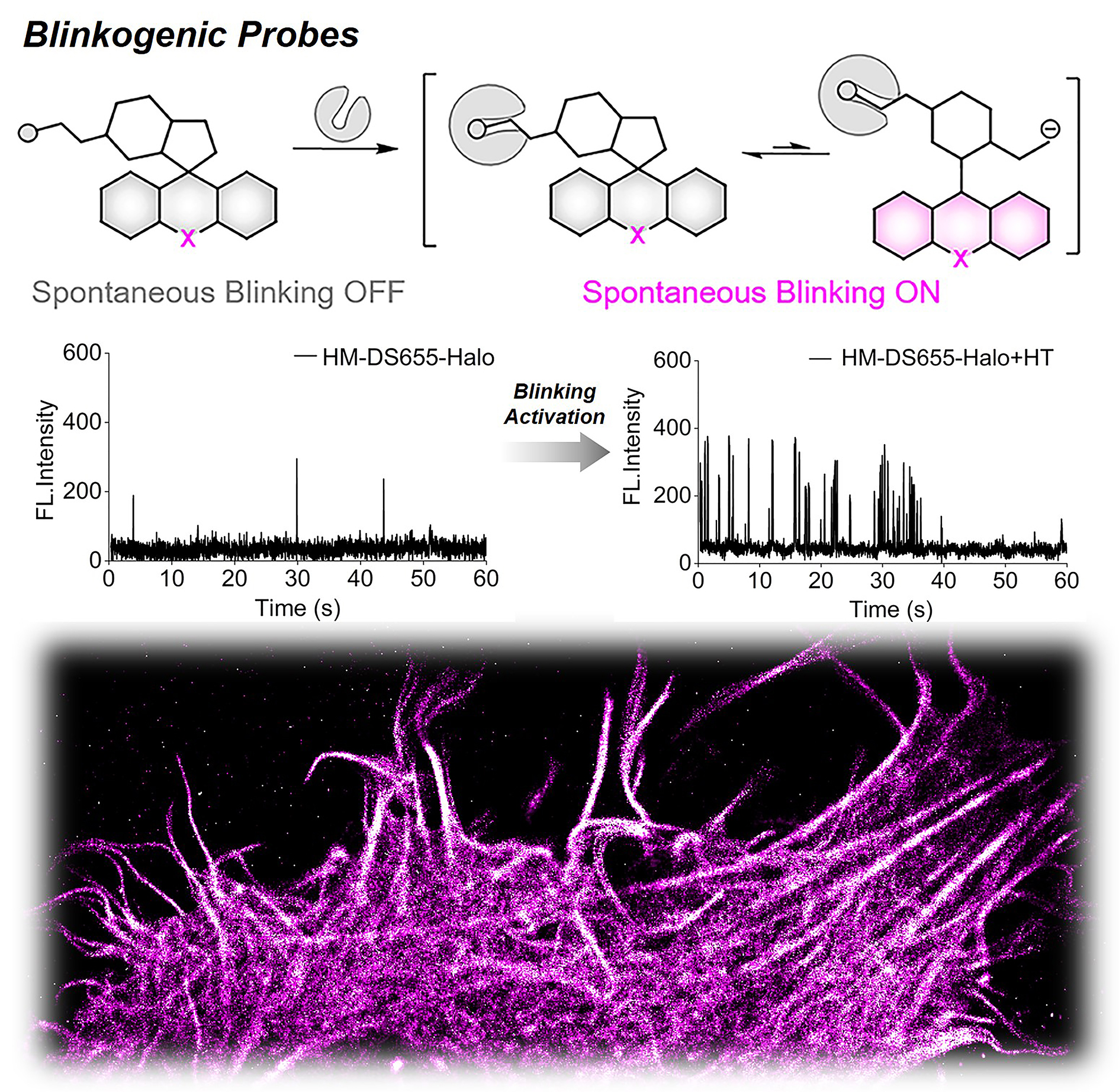
本工作中,团队发展的Blinkogenic Probe,可在与靶标结合前保持“沉默”状态,即不产生闪烁;而一旦与靶标结合,其自闪烁性能立即被激活,从而实现精确的单分子定位,有效避免了非特异性标记产生的闪烁背景。为了量化这一特性,团队引入了新的参数“RDC”,定义为自闪烁激活前后的占空比比值,其中占空比为荧光探针在一定时间内的荧光“亮”态占比。当RDC值大于1时,表明荧光探针在识别靶标后发生了自闪烁激活现象。本工作报道的HM-DS655-Halo的pKcycl为4.5以下,在生理条件下(pH=7.4)能够保持自闪烁“沉默”状态,而与HaloTag结合后,其两性离子结构被进一步稳定,从而激活了自发闪烁。该探针的RDC值达到12,证明了识别HaloTag蛋白能够高效激活探针的自闪烁性能,并在SMLM成像中有效消除了闪烁背景的干扰。利用这一探针,团队实现了细胞内动态的SMLM成像,包括线粒体分裂和接触、细胞迁移和伪足生长等过程。此外,团队利用该探针能够精确追踪活细胞中的各种伪足结构,如丝状伪足、片状伪足和隧道纳米管(TNT),并揭示了丝状伪足和片状伪足之间的两种不同融合模式,以及TNT的形成及其与丝状伪足的相互作用。这些发现充分证明了Blinkogenic Probe自闪烁超分辨荧光探针在纳米尺度上可视化实时伪足动态的实用性。
相关研究成果分别以“Spontaneously Blinkogenic Probe for Wash-Free Single-Molecule Localization-Based Super-Resolution Imaging in Living Cells”和“Super-resolution imaging of cellular pseudopodia dynamics with a target-specific blinkogenic probe”为题,于近日发表在《德国应用化学》(Angewandte Chemie International Edition)和《中国化学快报》(Chinese Chemical Letters)上。该工作的共同第一作者为1818组硕士研究生宋澳旋和乔庆龙副研究员,以上研究工作得到国家自然科学基金、我所创新基金等项目的资助。(文/图/乔庆龙)
文章链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202417469、https://www.sciencedirect.com/science/article/pii/S1001841724011604






