近日,我所生物分离分析新材料与新技术研究组(1809组)邹汉法、叶明亮研究员等人在定量蛋白质组学新技术新方法研究方面取得新进展。相关研究成果发表在最新一期的Angew. Chem. Int. Ed. 上(2013年52卷,9205-9209页)(http://onlinelibrary.wiley.com/doi/10.1002/anie.201303429/abstract)。
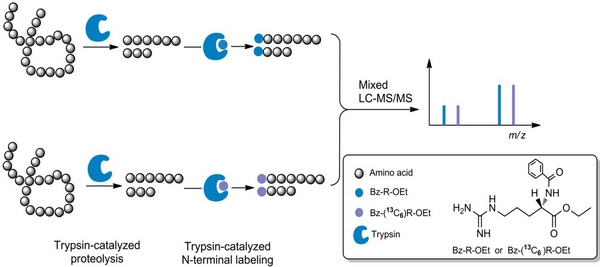
该项研究工作利用胰蛋白酶的连接活性,发展了特异性N端稳定同位素标记肽段的新方法,并成功应用于定量蛋白质组学分析。首先,与传统蛋白质组方法一样,将蛋白质样品在水相缓冲溶液中经过胰蛋白酶酶解产生肽段。然后,利用新型的酶促化学反应进行标记。肽段样品经过冻干后,转移到含微量水的乙醇体系中,又在胰蛋白酶的催化下将稳定同位素编码的精氨酸连接到这些肽段的N末端,从而实现对肽段的同位素标记和蛋白的相对定量。该酶促标记反应条件温和,具有高度标记区域的专一性,大大减少了常规化学标记方法中肽段降解和副反应的发生。胰蛋白酶作为水解酶通常用来酶解蛋白质,但在本工作中被用来作为连接酶,催化稳定同位素编码的精氨酸连接到胰蛋白酶酶解后的肽段的N末端。与一般的标记方法不同,在基于胰蛋白酶标记的反应形成了新的肽键,而且每个肽段只在N端标记上一个含同位素的氨基酸,由于新的肽键也能在串联质谱中解离,所以新形成的其他碎片离子能大大提高的肽段的鉴定准确度。利用特异性N端标记的特性可以提取并形成丰富的b和y离子,在肽段的从头测序方面也有良好的应用前景。这种酶促标记反应为蛋白质组学定量分析提供了一个全新的方法和技术平台。(文/图 潘彦博)






